为了确定哪种方法最适合您的实验应用,以下是您应该考虑的一些事项。
基本原理
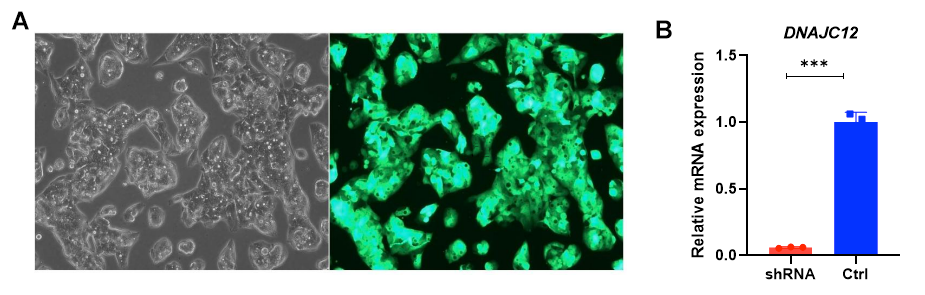
基因敲低载体表达shRNA抑制靶基因的mRNA,通过引发mRNA的切割抑制翻译过程。shRNA敲低不改变靶基因的DNA序列。
CRISPR和TALEN都是通过指导核酸酶切割基因组中的特定靶位点来发挥作用。然后这些切割位点被细胞低效地修复,从而导致修复部位的永久性突变,比如产生基因的小片段插入或碱基缺失。这类突变的一部分会导致基因的阅读框移码、出现提前终止密码子等,最终导致目的基因的功能丧失。如果同时靶向基因组中两个相邻紧密的切割位点(距离几个kb),也可以导致其间区域的删除。
效率
shRNA敲低永远不会完全抑制靶基因的表达。即使对于最有效的shRNA,靶基因的一些残留表达也会保留。相比之下,在一小部分经过处理的细胞群中,CRISPR和TALEN可以产生永久性突变,这可能导致基因功能完全丧失。
一致性和均一性
shRNA载体通常在转染/转导的细胞时获得较好的均一性,实验之间的一致性也较佳。相比之下,由于引入突变是随机的,CRISPR和TALEN的基因编辑效果在细胞之间的差异相当大。为了完全敲除细胞中的目的基因,必须敲除细胞中基因的所有拷贝。鉴于正常细胞具有任何基因的两个拷贝(X或Y连锁基因除外),而癌细胞可以具有两个以上的拷贝,这种完全敲除的细胞可能只占所有处理后的细胞的一小部分。出于这个原因,核酸酶介导的敲除实验需要通过测序来筛选克隆,以确定所有目的基因拷贝都被敲除的子细胞群。
脱靶效应
已有报道表明shRNA介导的基因敲低和核酸酶介导的基因敲除均会产生脱靶效应。脱靶效应的表征可以通过使用多个不同的shRNA 靶向同一基因来评估。如果一个基因被在多个不同的shRNA作用下仍然表现出一致的表征,则这种表征通常则不是脱靶效应带来的。对于CRISPR或TALEN基因敲除,应分析含有功能丧失突变的多个克隆,以包含可能由脱靶突变引起的任何表征。此外,可以对克隆进行脱靶位点测序,通过生物信息学方法鉴定以查看它们是否已发生突变。