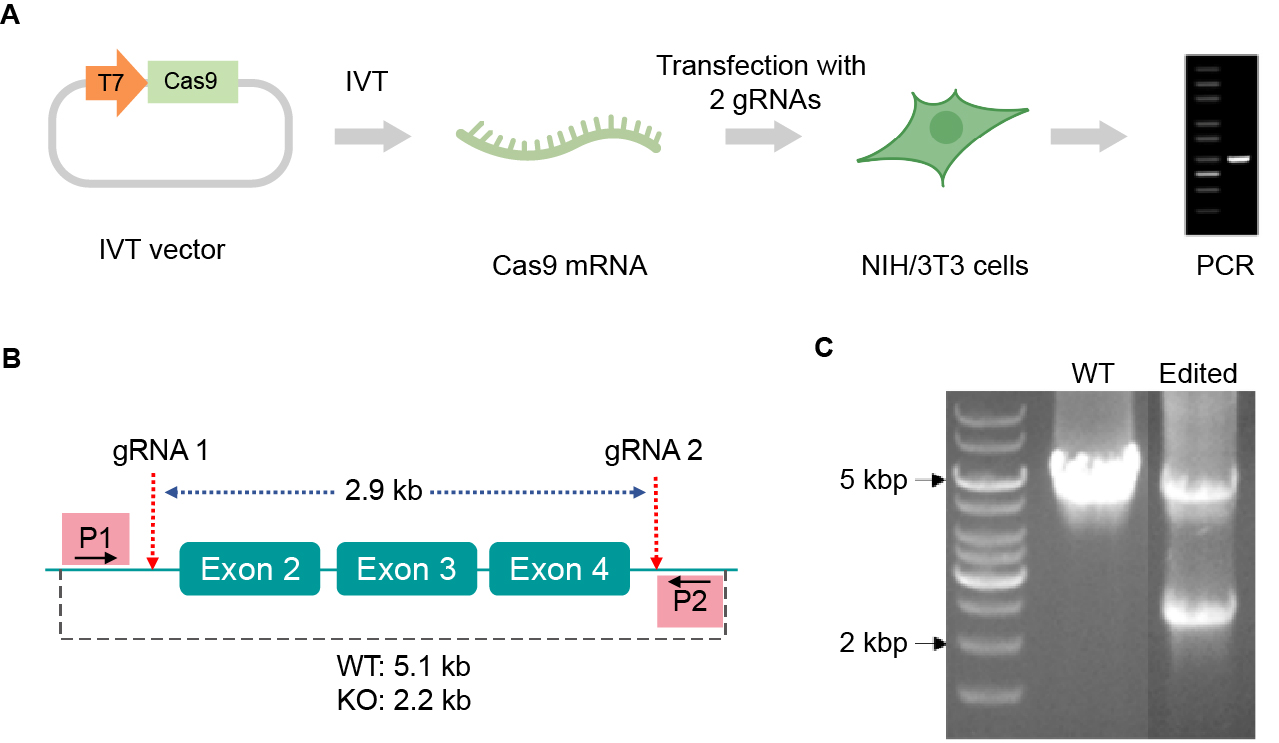
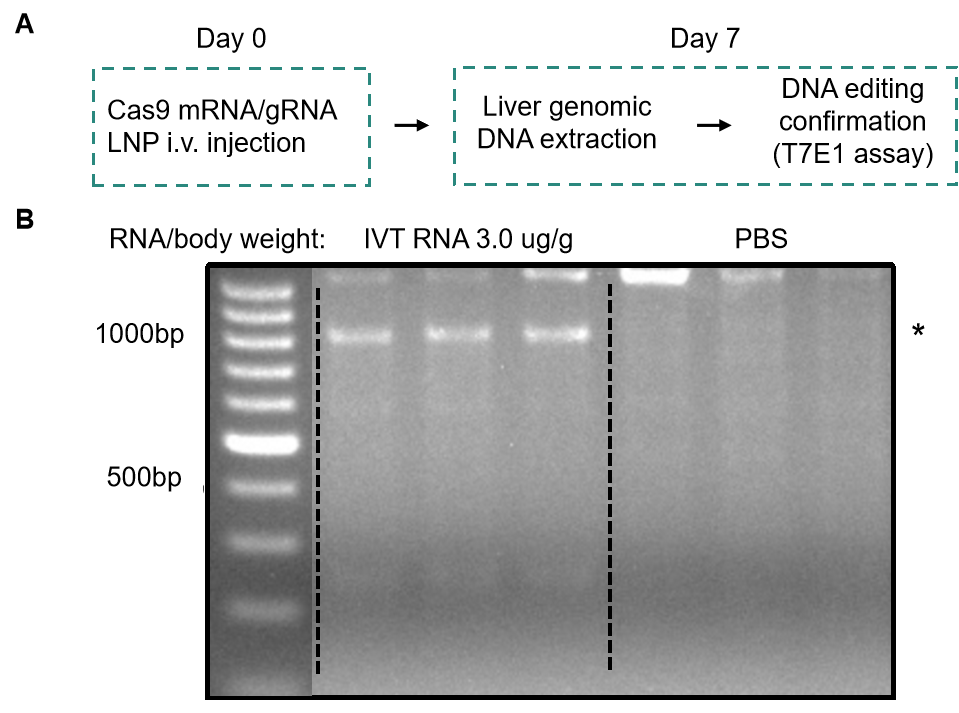
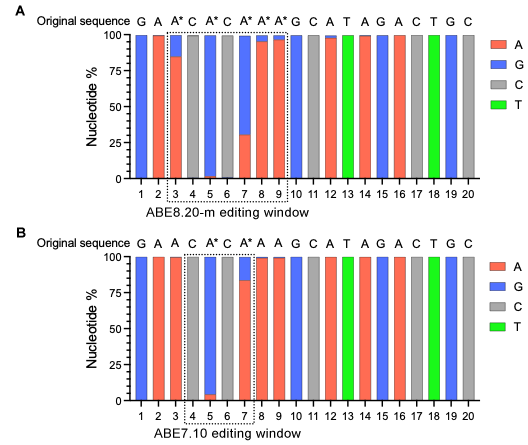
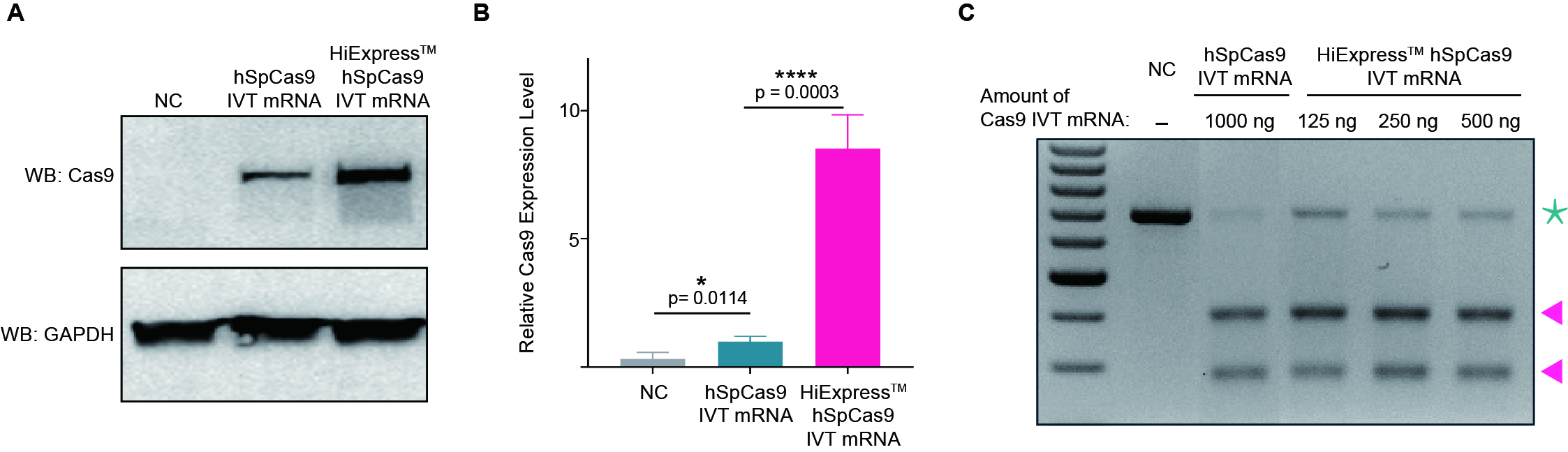
CRISPR-Cas9可以通过多种方法递送,包括质粒、重组病毒、gRNA-Cas9 RNP复合物,以及gRNA和Cas9 IVT mRNA的混合物,而这些方法都有各自的优势和局限性。研究人员应选择适合自己实验应用的递送方法,旨在通过最小化脱靶效应和不良效果获得最佳的编辑效率,而IVT RNA正迅速成为其中一种效果良好的基因编辑工具。
质粒的大量制备一般成本较低,并且可以通过技术相对简单的化学转染和电穿孔进行递送。然而,由于这些递送方式的自身特性,使得质粒载体主要限于体外应用。此外,质粒转染的效率在不同细胞类型之间差异很大,且转基因表达依赖于特定细胞类型的启动子活性,而这在某些系统中可能会降低转基因的表达效率。因此,质粒系统倾向配合使用高活性的启动子以确保Cas9的高水平表达,但是这也会增加脱靶效应和质粒DNA随机整合到宿主基因组中的风险。
重组病毒是递送CRISPR-Cas9的另一种常用工具,特别适合难以转染的细胞类型,并且可以创建稳定表达Cas9的细胞系以用于需要导入多个gRNA的实验。然而,该系统同样与质粒递送系统一样存在诸多相同的限制,包括依赖特定细胞类型的启动子,以及由于长期表达Cas9而导致的脱靶效应风险增加。此外,重组病毒也会带来较高的插入突变风险,特别是在逆转录病毒和慢病毒系统中的Cas9基因整合细胞基因组的时候。
通过gRNA-Cas9 RNP复合物递送可以绕过质粒和重组病毒系统的许多限制,同时实现快速编辑,因为不需要进行转录或翻译。然而,由于需要使用电穿孔方式实现高效的递送,这种方法同样主要限于体外应用。通过这种方法进行的基因编辑发生得很快,但随着Cas9在宿主细胞中被降解,编辑效果会迅速减弱,因此常受到可用的Cas9蛋白的类型限制。
与上述方法相比,使用gRNA和Cas9 IVT mRNA的混合物进行递送当前已被认为同样是一种高效的基因编辑方法,具有最小化脱靶效应的优点。该方法中,gRNA和Cas9 IVT mRNA一起被封装在脂质纳米颗粒或化学转染试剂中,使得该系统适用于体外和体内应用,并且无需担心存在整合宿主基因组的风险。此外,由于不需要进行转录,转基因的表达不依赖于特定的细胞类型启动子活性,翻译的发生也相对更快,从而实现快速且高效的基因编辑。与gRNA-Cas9 RNP复合物相比,mRNA形式的Cas9基因具有更长的表达时长,可达成充分的基因编辑效果。然而,mRNA最终也会被降解,编辑仅暂时发生过,从而限制了脱靶效应的影响。
总而言之,通过质粒、重组病毒和gRNA-Cas9 RNP复合物递送CRISPR-Cas9组分的方法均存在较多限制,对它们在许多场景中的应用造成了阻碍。这些方法具有明显的缺点,包括相对有限的编辑效率、较高的脱靶效应风险以及插入突变的潜在风险等。相对地,基于gRNA和Cas9 IVT mRNA混合物的递送方式具有诸多优点和较少的限制,是一种高效的基因编辑方法,应更多地被考虑用于基因编辑实验。